版权所有 河南省药学会 豫ICP备17043728号
为学习交流临床试验全程规范化管理的最新理念,提升备案制下全省新药临床试验的质量,培养临床试验从业人员的临床研究素养,提升伦理审查的效率和质量。2021年7月2日,由河南省药学会药物临床试验专业委员会主办,河南省肿瘤医院承办的“药物临床试验质量管理高峰论坛暨药物临床试验专业委员会2021年年会”在河南省肿瘤医院顺利举办。
会议共邀请10位讲者从药物临床试验宏观板块和热点话题出发,围绕抗肿瘤临床试验设计、临床试验研究及真实世界研究的管理和伦理学考量、临床研究中心数字化建设、机构团队建设及质量控制等方面进行了分享和探讨。河南省药学会副理事长兼秘书长史艳玲,河南省药学会药物临床试验专委会主任、河南省肿瘤医院副院长罗素霞出席会议并为会议致辞。为降低疫情防控风险,本次会议以线下、线上同步直播的形式召开,150余人参加了线下会议,线上累计在线观看人数达5.55万人次。

线下会议现场
史艳玲秘书长致辞中指出,临床试验是抗肿瘤药物以及医疗器械上市的必经之路。我省医药工作者对药物临床试验研究工作表现出了较高的兴趣和热情,目前河南省备案机构数量已达62家,机构数量在全国各省市排名第5,河南省药学会将持续关注和支持我省药物临床试验工作,继续组织相关培训,提升临床研究从业人员的临床研究素养,推进我省药物临床试验行业的发展。
河南省药学会药物临床试验专业委员会主任委员、肿瘤医院副院长、机构主任罗素霞在致辞中指出,为适应我国药物创新研究快速发展的需要,河南省药学会药物临床试验专业委员会GCP培训班自2018年成立以来,举办相关培训7期,线下培训学员3000余人,专委会将再接再厉,努力引领我省药物临床研究的持续进步,为国家药物临床研究事业的发展进步贡献应有的力量!

中山大学肿瘤医院洪明晃教授做《抗肿瘤临床试验设计特点》的报告。洪教授强调的肿瘤临床研究设计要以保护受试者为核心,筛选期需避免中心实验室检查结果的滞后耽误肿瘤患者病情,受试者采血营养补助需到位等细节引起了在场学员的共鸣。宏观方面肿瘤临床研究设计还需要多方面考量。指出适应性设计、篮式/伞式设计、桥接研究等新型临床研究设计加快了新药研发进程。

中国抗癌协会继教与科技服务部阎昭部长做《研究者发起临床研究的现状及规范化管理》的报告。从临床研究的现状与展望、伦理审查要素、风险获益评估以及安全性事件报告等多个方面讲解了如何规范研究者发起临床研究,使其有所产出且更加造福受试者。
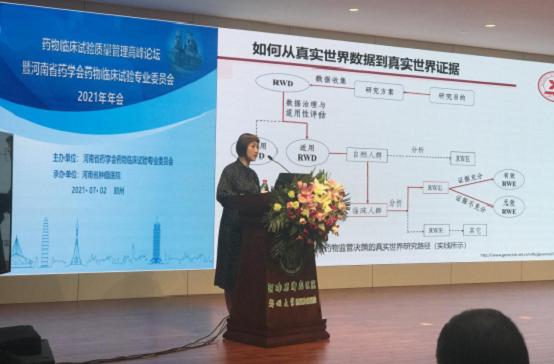
中南大学湘雅医院肿瘤化疗科主任曾珊教授做了《从真实世界数据到真实世界证据》的报告。从真实世界研究的案例出发,阐明了如何从复杂的临床试验数据转变为临床研究证据从而指导临床运用。

复旦大学肿瘤医院机构办主任刘燕飞教授做了《信息化建设助力机构临床效率和质量提升》的报告。分享了复旦大学肿瘤医院自身信息化建设经验,指出医院GCP信息化管理涉及院内院外多个部门,具有复杂性。如何实现临床研究全流程信息化管理、远程监查、临床试验动态实时监管、研究者培训线上化管理等是目前机构信息化管理提升的方向。

蚌埠医学院第一附属医院机构办主任周焕教授做了《临床研究中心的绩效管理及团队发展》的报告。周主任指出机构需要有绩效考核与分配制度作为临床研究的物质激励并逐渐形成职业化的研究团队。绩效考核要从财经政策和国家法规为指导;成本核算、保障医院利益;公正公平、多劳多得、动态平衡;关键目标考核等方面出发,提升临床研究管理人员的积极性和热情,从而促进临床试验的健康发展。

湖南省肿瘤医院机构办主任李坤艳教授做了《临床研究协调员的管理及机构质控模式》的报告。她指出临床研究协调员(CRC)工作质量好坏对试验质量起着十分重要的作用,机构有义务管理好CRC并为其提供相应的设备设施和工作场所,目前医院优选CRC公司进行合作是CRC管理的普遍模式。

中国医学科学院肿瘤医院院长助理李宁教授做了《如何利用临床研究数据库产出高质量临床研究论文——机构管理人员的科研出路》的报告。李宁教授指出临床研究是一个专业的学科,是一项专门的科学,是一门值得认真探索的事业,是医学发展、人类健康的基石。机构管理人员可以从临床实践出发、从机构管理出发、从行业及监管热点出发,根据个人喜好挖掘出现阶段研究热点,从解决临床研究的实际问题出发,产出有指导意义的高质量文章。

南方医科大学南方医院药物临床试验机构办主任许重远教授做了《真实世界研究的伦理考量与知情同意》的报告。指出了行业内“泛知情”的不规范,强调了“泛知情”在受试者捐献剩余样本的声明页,患者需要单独签字并充分知晓,理解并同意全部条款,从而保护受试者的权益和隐私。

中南大学湘雅医院肿瘤神经外科主任医师李学军教授做了《数字驱动下的脑肿瘤研究进展》的报告。展示了团队研究成果,分享了数字化时代如何寻求临床诊疗突破的思考。
河南省药学会药物临床试验专业委员会罗素霞主任委员做了《药物临床试验机构备案的问题及对策》的报告。分享了机构备案准备的关键以及备案的常见困惑,解答了新机构新PI如何满足承接3个临床试验的条件,她提到根据河南省药监局2021年机构监督检查的通知,PI承接3个临床试验可以包括研究者发起的临床研究或者IV期药物临床试验。备案制使得机构门槛降低了、但竞争更强了,保证药物临床试验质量及效率才是硬道理,才能让新机构吸引更多临床试验项目。
本次会议是在举国庆祝中国共产党成立100周年之际召开的一次会议,聚焦了当前药物临床研究的热点,展示了药物临床试验的最新研究和规范化管理进展,体现了新时期我国药品研发、药物临床试验创新成果竞相涌现,药物临床试验领域集聚发力、学术氛围浓厚热烈的可喜现状。省内外学术思想的交流碰撞为我省药物临床试验的规范、健康、持续发展注入了新的活力,专委会也将为健康中原建设做出更大更新的贡献。