版权所有 河南省药学会 豫ICP备17043728号
为提升新药临床试验的质量和效率,帮助临床研究从业人员更好地了解国家药物临床试验政策变化、提升专业知识和技能水平,培养高水平临床研究人才,由河南省药学会药物临床试验专业委员会举办的“药物临床试验质量管理高峰论坛暨伦理审查规范化培训班”于2022年5月13日至14日在线上顺利举办。
河南省肿瘤医院罗素霞副院长担任大会主席,共邀请14位业内知名专家分享临床试验中各个领域的相关经验,从宏观板块和热点话题出发,包括但不限于新政策下医疗器械和体外诊断试剂临床试验的管理、以临床价值为导向的新药研发和方案设计、人类遗传资源管理、临床试验各方职业化道路探索等。
本次会议由于疫情原因,以线上形式举办,会议质量、直播效果和参与人数都取得了很好的成效。会议举办时长约14个小时,线上累计在线观看人数达8.62万人次,得到参与学员的一致肯定和好评。
河南省药学会史艳玲秘书长在开幕致辞中指出,临床试验是肿瘤药物以及医疗器械上市的必经之路。一直以来,我省参与药物临床试验工作的积极性很高,河南省备案机构数量已达75家。药学会将继续组织相关培训,持续推进我省药物临床试验行业的发展进步。

史艳玲秘书长致辞
开幕式之后,“中原数字化临床研究平台”启动仪式在线举办,20家参与机构共同发声:“共研共创,河南临床研究加油”。此平台的开设旨在通过信息化平台建设加强省内机构和研究者宣传、提升受试者招募效率,提高临研人的学习效率。启动仪式上展示了全省20家机构的临床试验机构情况,也期待省内更多临床研究机构参与平台建设工作,达到整合资源、助力临研的目的。
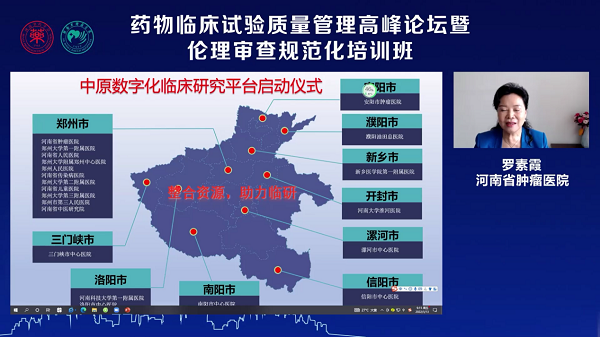

“中原数字化临床研究平台”启动仪式

中山大学肿瘤医院洪明晃教授分享了《药品注册核查要点与判定原则》,对临床试验实施过程中的合规和细节问题提出了实操性的建议。

中国抗癌协会继教与科技服务部阎昭部长分享了《机构质量体系建设及第三方稽查的管理》,他提出了“人”是临床研究质量的要素之首,包括研究者、受试者、伦理委员会、临床试验监查员、协调员共同协作才能高质高效的完成临床试验。

河南省药学会药物临床试验专业委员会罗素霞主任委员做了《研究者眼中的临床试验和临床实践》的报告。从一个临床试验研究者的角度剖析了临床试验和临床实践的区别和联系,她指出临床试验为临床实践提供循证医学证据,临床实践为临床试验及新药研发提供新的思路和方向。

应世生物创始人王在琪博士分享了近期的热点话题《以临床价值为导向的抗肿瘤新药研发与设计》,他从企业新药研发的视角,通过临床研究成败的案例深入浅出的解析了什么是以临床价值为导向的新药研发,药物同质化引起的商业失败是药品上市未获得成功的原因之一,因此应不断寻找临床的痛点、难点。他指出,价值为导向差异的药物研发决定创新企业的将来。

四川大学华西医院临床试验中心主任王永生分享了《抗肿瘤药物研发趋势与早期临床试验进展》。他分析了近年来抗肿瘤药物研发的现状,创新药物研发加速明显,肿瘤药物为热点领域,但临床的价值值应该成为研发的重要考虑。创新药早期临床试验可以从剂量优化探索、生物标志物和伴随诊断以及无缝设计等方面进行突破。

中山大学附属第三医院临床研究中心主任孙健分享了《新版器械GCP下医疗器械和体外诊断试剂临床试验的质量控制》,他梳理近年来器械和体外诊断试剂法规的进展,结合新出台的器械GCP法规,提出了知情同意、方案实施、器械管理和数据溯源是器械/体外诊断试剂临床试验的主要风险点。

河南省肿瘤医院总药师、伦理委员会主任委员张文周分享了《新形势下临床研究伦理审查理念更新与能力提升》他结合中共中央办公厅,国务院办公厅2022年3月发布的《关于加强科技伦理治理的意见》,从伦理审查的角度剖析了机构如何加强科技伦理治理能力,指出加强科研人员伦理教育培训,能促进公众理解和参与。

中国医学科学院肿瘤医院伦理总监吴大维分享了《药物临床试验期间安全性报告常见问题》,他提出安全性事件管理是药物临床试验风险管理的关键环节,从实际案例出发分析了申办方和研究者在安全性事件报告中承担的角色。

中南大学湘雅三医院临床试验研究中心主任阳国平分享了《协调院内资源提高研究团队积极性的探索》,他提出数字化GCP平台促进了临床研究科学、规范、创新发展,目前影响临床研究团队积极性的五大因素包括经济利益、实施便利、监管担忧、晋升评价以及价值认同。

河南省肿瘤医院机构办主任贺宝霞分享了《临床试验机构如何加强人类遗传资源管理》,她从人类遗传资源的重要意义、重点内容、法律责任、临床试验机构加强人遗管理措施以及常见问题分析5个方面,从实操层面上细致解读了新法规新形势下人类遗传资源管理的要求。

中国医学科学院肿瘤医院院长助理、河北医院院长李宁教授分享了《中国临床试验行业发展的思考和畅想》,他介绍了中国医学科学院肿瘤医院空间、人员、研究者、管理者多角度职业化发展路径,并在全国率先将临床研究纳入科室绩效考核和医生职称评定体系。最后,李宁主任提出:我们立足中国做临床研究并不只为了中国做临床研究,而是为了医学的进步、学科的发展和人类的健康。

北京诺诚健华医药科技有限公司临床运营执行总监黄怡分享了《药企临床试验相关热门职位的发展和机遇》她从临床试验热门人才需求、临床试验人才核心竞争力、申办方岗位角色的发展和机遇3个方面出发从申办方角度,阐述了临床研究职业化发展。

泰格医药集团中心监查管理部总监吴宝林分享了《从CRO视角探索临床试验人员职业化发展》他以CRA岗位及数据统计岗位为例阐述了CRO角色中的晋升路径,并提出制定职业发展计划的4要素即:个人职业发展目标是什么、实现个人职业发展目标需要什么样的能力、评估自身当前能力、学习并有计划地提升职业能力。

铭蓝医疗科技南京有限公司总经理徐波分享了《临床试验人才职能模型与职能发展》,他从职能概念与职能模型的由来、PM&CRA职能模型开发实践、行业职能测评数据分享、个人职能发展与企业绩效成长4个方面深入阐述了临床试验职业化发展路径,并描绘了人才识别、人才培育、人才考评、人才用留的企业人才发展蓝图。
会议闭幕时,大会主席罗素霞副院长做了会议总结。她指出,临床试验是一个多方参与、精益求精的活动,申办方、合同研究组织、临床试验机构等同心协力才能高效完成。本次会议聚焦了当前药物临床研究的热点,展示了药物临床试验的最新研究和规范化管理进展,体现了新时期我国药品研发、药物临床试验创新成果竞相涌现、药物临床试验领域集聚发力、学术氛围浓厚热烈的可喜现状。省内外学术思想的交流碰撞为我省药物临床试验的规范、健康、持续发展注入了新的活力,专委会也将继续为健康中原建设做出更大更新的贡献。